在生物制药行业中,从一个项目走向一个产品,工艺转移是不可避免的。无论是从实验室规模走向中试测试、或是从中试放大走向生产端、甚至于生产场地或设备限制导致的工艺变更,均会导致工艺的流程、设备、生产场地甚至于关键参数产生变化。在这个变化的流程中,工艺转移作为一个既受到产品自身的工艺关键参数控制,又需要符合自己及所在地区监管机构要求的关键步骤,需要技术、管理及合规性的综合协调。
常见的技术转移从项目流程上可分为小试至中试、中试至生产、生产流程中这几个阶段,其中的前两个阶段一般会伴随着工艺放大同步进行,后两个阶段可能会涉及到IND申报或GMP核查,对控制流程的要求相对较高。
标准流程:
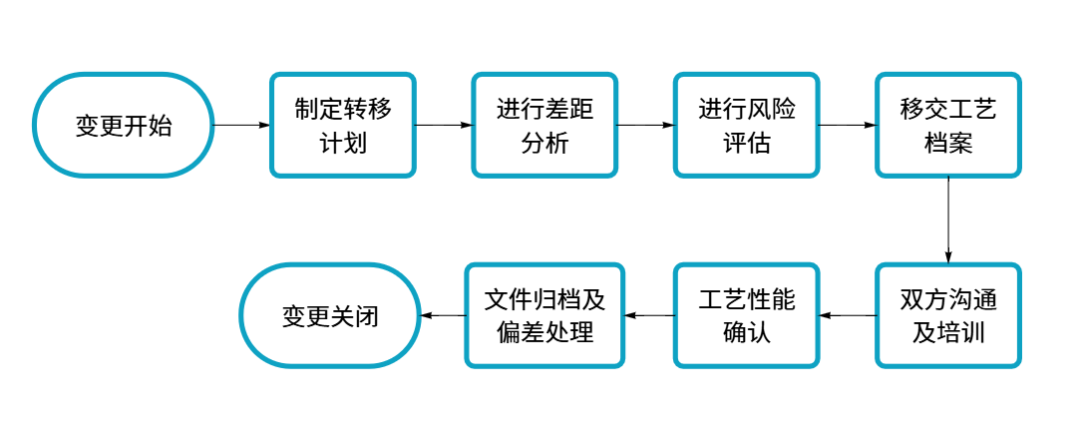
在工艺转移的流程中,至少应该符合以下的原则
流程合规性
整体工作流程及文件要求必须符合GMP要求,若项目涉及多国家/地区,也应符合对应的FDA/EMA/ICH等要求,所有的变更文件,风险评估,行动项目均应在实际执行前进行审核确认,存档备案。
文件、数据完整性
在工艺转移流程中,必须保证经过转移的工艺流程、关键工艺参数(CPP)、关键质量属性(CQA)和生产中的风险点信息均完整可靠,所有需要的工艺原理、设备属性、操作细节可通过培训或实操进行交接。
充分的风险评估及控制方案
对工艺转移前后的人员、设备、物料、文件体系、生产环境进行对比确认。对其中可能存在的问题进行充分的风险评估,建立风险评估矩阵,按照等级划分不同的控制方案。最终以风险等级和控制策略为依据,输出对应的行动项。
变更项测试及评估
在涉及同步进行的工艺放大,或是由设备属性、参数不同导致的关键工艺参数/质量属性变更时,常规的风险评估和控制策略不足以作为变更的依据,此时应引入对应的验证方案,通过实验数据证明变更的可行性和对项目本身的影响,通过升级工艺、更换设备、加强控制最终将转移后的影响降至最低。
工作协作
在整体的工艺转移流程中,涉及转移方案的起草、设备变更确认,整体风险评估以及其他可能存在的控制方案和测试内容,这些需要转移前后两个部门进行协作,由质量控制部门进行整体统筹和确认,应定期进行项目进度沟通,以防止可能存在的问题。
在GMP体系内,一切方案的起草和执行都依赖于系统性规划、严格的风险管理和跨团队协作。只有将技术细节、人员能力和监管要求紧密结合,才能确保工艺在新环境中稳定运行并持续符合质量标准。
· 关于艾贝泰 ·
艾贝泰生物科技有限公司(Applitech Biological Technology Co., Ltd.)作为一家集设计、研发、生产、销售和服务于一体的高新技术企业,致力于为生物制药领域提供专业的生产及分析设备、一次性耗材和整体解决方案。从成立至今,我们始终以客户为中心,将“质量为本,服务为先”作为经营方针,立足于生物工艺的优化、放大和生产,不断完善生物制药领域的产品线,为用户提供全方位生物工艺的专业解决方案,助力用户在生物制药领域不断取得新的突破。
艾贝泰深耕生物反应器领域将近20年,立志打造高端自主生物反应器。我们的生物反应器覆盖从研发、中试以及cGMP生产多领域,广泛应用于抗体、疫苗、细胞治疗、基因治疗以及干细胞治疗等领域的研发及生产。以生物反应器为业务核心,我们逐步形成涵盖过程检测、光谱分析、细胞分析、在线取样、样品处理等的产品布局,为国内外生物制药企业提供了广泛的产品与技术服务。
艾贝泰的销售及售后服务网络遍布全国,总部位于广州,在上海、北京设立分公司及产品展示及应用中心,在成都、西安等地设立办事处,在天津、苏州、杭州、武汉、南京、兰州、长春、青岛等地设置服务点。艾贝泰秉承“技术专业、服务周到、行动快速”的服务宗旨,以客户为导向,与技术伙伴紧密合作,共同为生物制药产业的发展保驾护航!
