胰腺癌,尤其是胰腺导管腺癌(PDAC),是全球癌症相关死亡的第三大原因。由于其肿瘤微环境复杂,突变负荷较低,传统的免疫疗法(如免疫检查点抑制剂等)收效甚微。因此需要对胰腺癌抗原谱进行更广泛的研究和筛选。
近年来研究已经发现,肿瘤细胞可以通过翻译部分非编码基因元件(长链非编码RNA、(lncRNA)、5′或3′非翻译区(UTR)以及替代阅读框(intORFs)等)产生“非典型”肽(cryptic peptides)。相对于肿瘤细胞,这些肽在健康组织中检测频率极低,且可被人白细胞抗原I类(HLA-I)分子呈递,因此具有作为免疫治疗靶点的巨大潜力。不过,在胰腺癌等大部分实体瘤中,非典型肽的研究仍旧不足。尤其非经典HLA-I结合肽(ncHLAp)的肿瘤限制性和免疫原性尚不完全清楚。
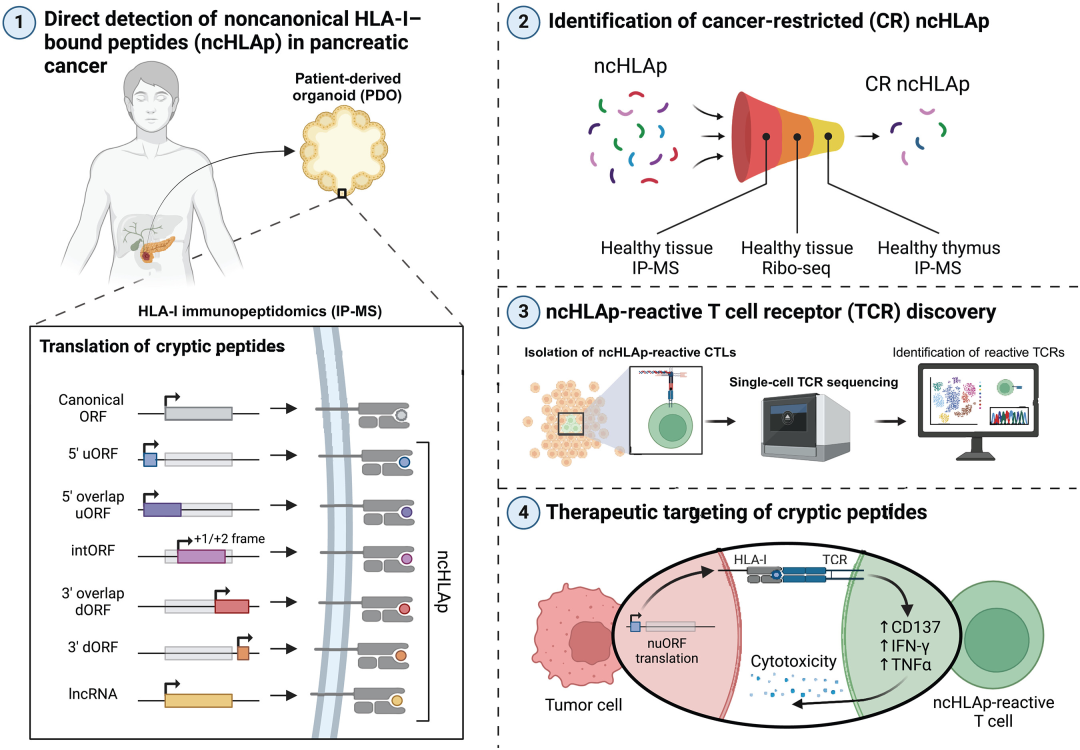
2025年5月8日,MIT及哈佛医学院研究团队在顶刊Science发表论文“Pancreatic cancer–restricted cryptic antigens are targets for T cell recognition”。研究团队使用患者来源的类器官(PDO),在体外重现并捕捉了胰腺癌患者个性化的分子及细胞特征,从而鉴定并深入评估了胰腺癌中ncHLAp的免疫原性。此外,研究团队还识别和分离了ncHLAp的T细胞受体(TCR),证明其具有肿瘤杀伤潜力。
01 患者来源类器官检索HLA-I呈递肽
由于恶性细胞在胰腺癌中占比较低(仅占胰腺原发性病变和转移性 PDAC 病变中总细胞质量的20-30%),为了对其富集以便高分辨率蛋白质组学分析,研究团队利用胰腺癌患者的肿瘤组织获得了在体外自组织的3D类器官平台(PDO)。
肿瘤微环境中的非肿瘤细胞(如基质细胞和免疫细胞等)可能也参与贡献HLAp,因而影响免疫组学数据的解读。在使用PDO富集肿瘤细胞并去除无关干扰后,研究人员发现,突变检测的灵敏度及对肿瘤源肽的特异性均有显著提升。
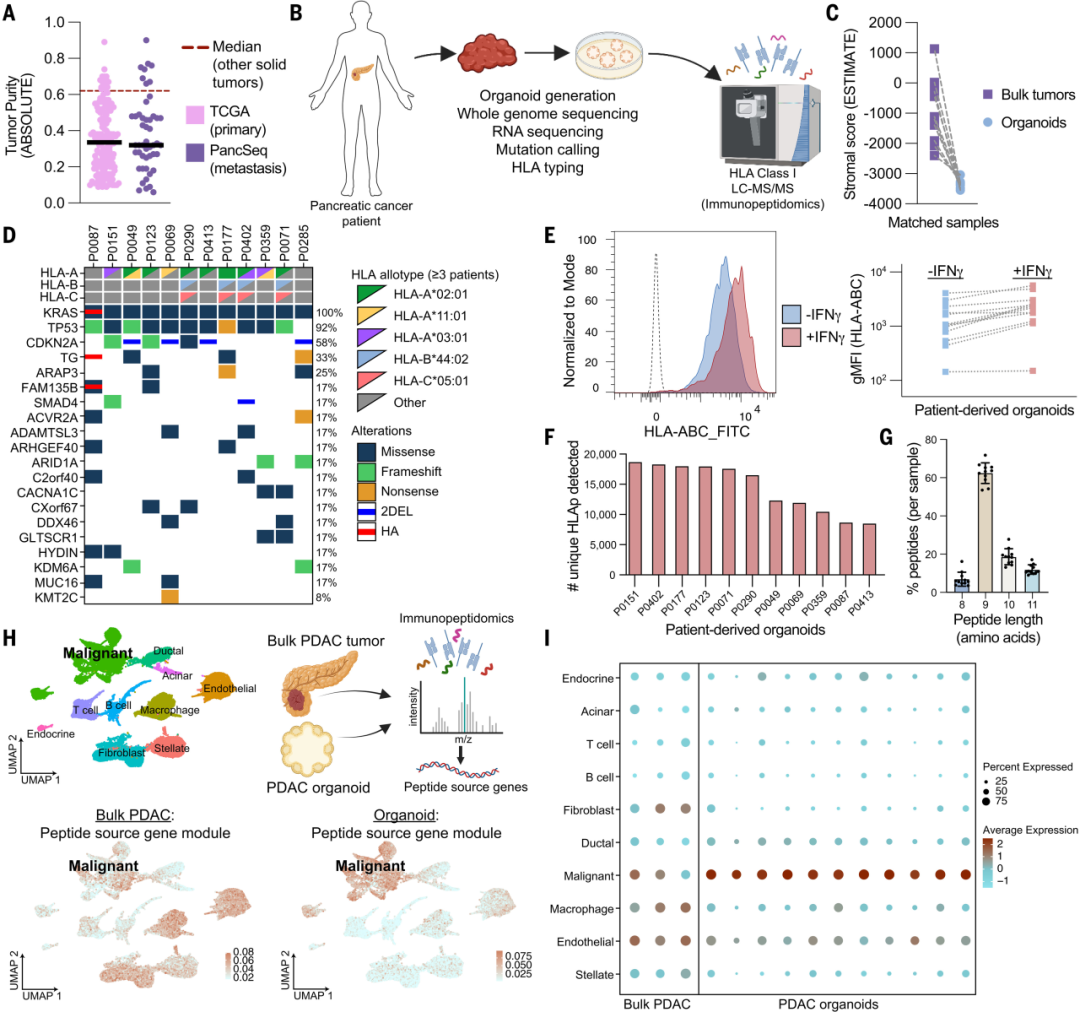
图:PDO可对胰腺癌免疫肽组进行高分辨率表征
在11个经过确认具有完整HLA-I表面表达和干扰素-γ (IFN-γ) 反应性的PDOs中,研究者们共鉴定出超过91,000个不同的HLAp肽,每个患者样本中检测到的HLAp数量在8,000到18,500之间,所获得的肽大多为8到11个氨基酸长度,符合HLA-I结合肽的典型特征。
以上结果证明,PDO是以高分辨率表征筛选胰腺癌HLA-I的良好体外平台。
02 非典型肽的发现
接下来,研究团队使用患者特异性突变扩大了每个PDO样本的蛋白质组学搜索空间,以探寻突变衍生的可能成为免疫治疗靶点的新表位(mutHLAp)。结果表明,尽管mutHLAp存在于部分样本中,但由于PDAC的突变负荷较低,其在大部分PDAC样本中并不常见,临床转化潜能较低,需要转而探索ncHLAp等其他抗原肽。
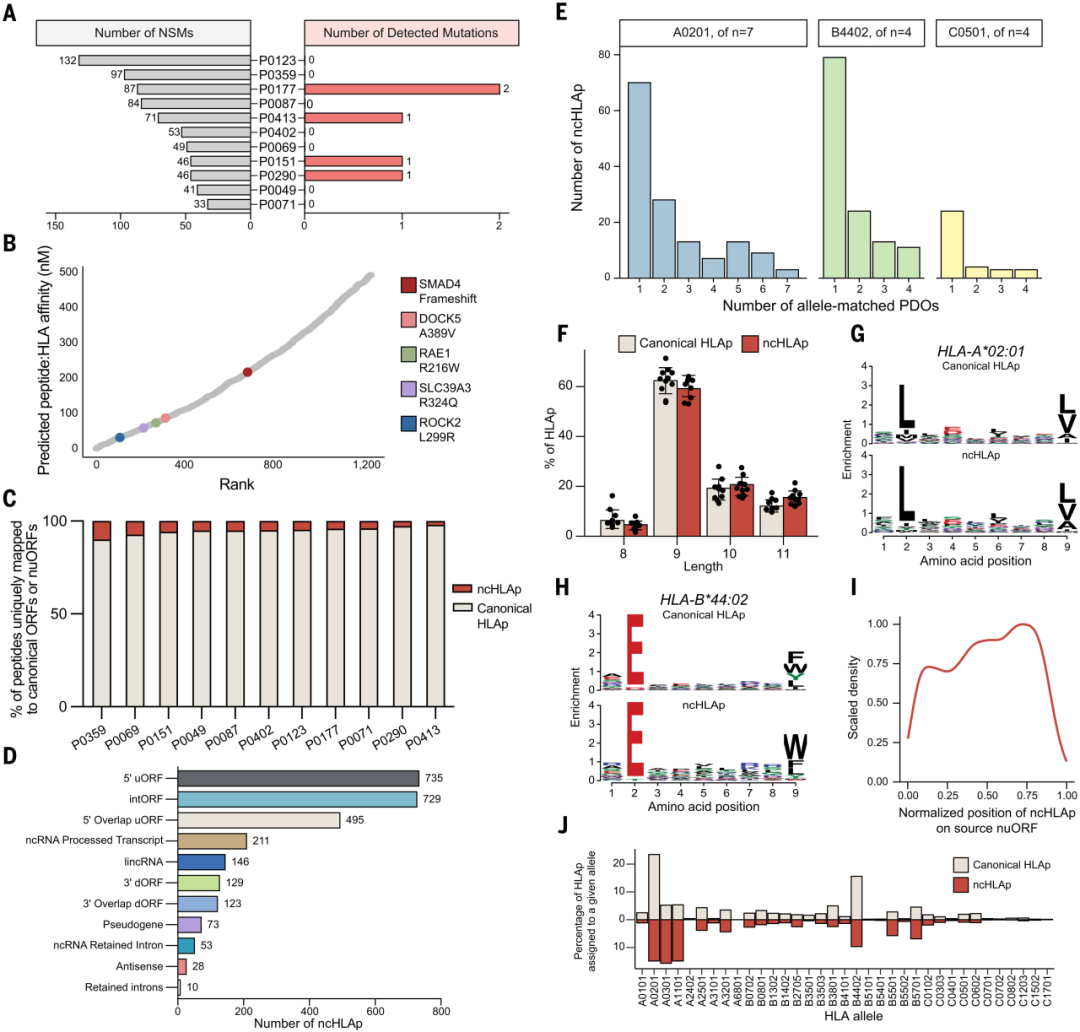
图:胰腺癌免疫肽组中隐蔽表位的检测
通过进一步扩大免疫肽组学搜索空间,研究人员接下来在11个PDO系中检测到了1722个ncHLAp,其在每个PDO中占总免疫肽组的2.2%至 10.1%,比mutHLAp更为富集。从PDO中鉴定出的ncHLAp的肽长度和 nuORF 生物型分布与原代肿瘤高度相似,表明PDO忠实还原了胰腺癌的患者特异性免疫特征。
值得注意的是,30.2%的非典型肽在任何健康组织中都未被检测到,这些只在肿瘤中表达的肽因此被称为肿瘤限制性非典型肽(CR ncHLAp),需要进一步探索作为临床靶点的价值。
03 肿瘤限制性CR ncHLAp的免疫原性
研究团队接下来使用高度敏感的体外T细胞激活和扩增平台,共评估了1100余种细胞毒性T淋巴细胞(CTL)和肽的组合。最终发现36.3%(12/33)的CR ncHLAp具有显著高于非CR ncHLAp的免疫原性(36.3%对8.7%)。
总而言之,CR ncHLAp免疫原性的比例和强度与更传统的肿瘤新抗原(mutHLAp,38.5%表现出免疫原性)相当。这一发现表明,肿瘤限制性CR ncHLAp可能非常适用于免疫治疗,例如TCR-T细胞疗法、疫苗或T细胞接合剂等。
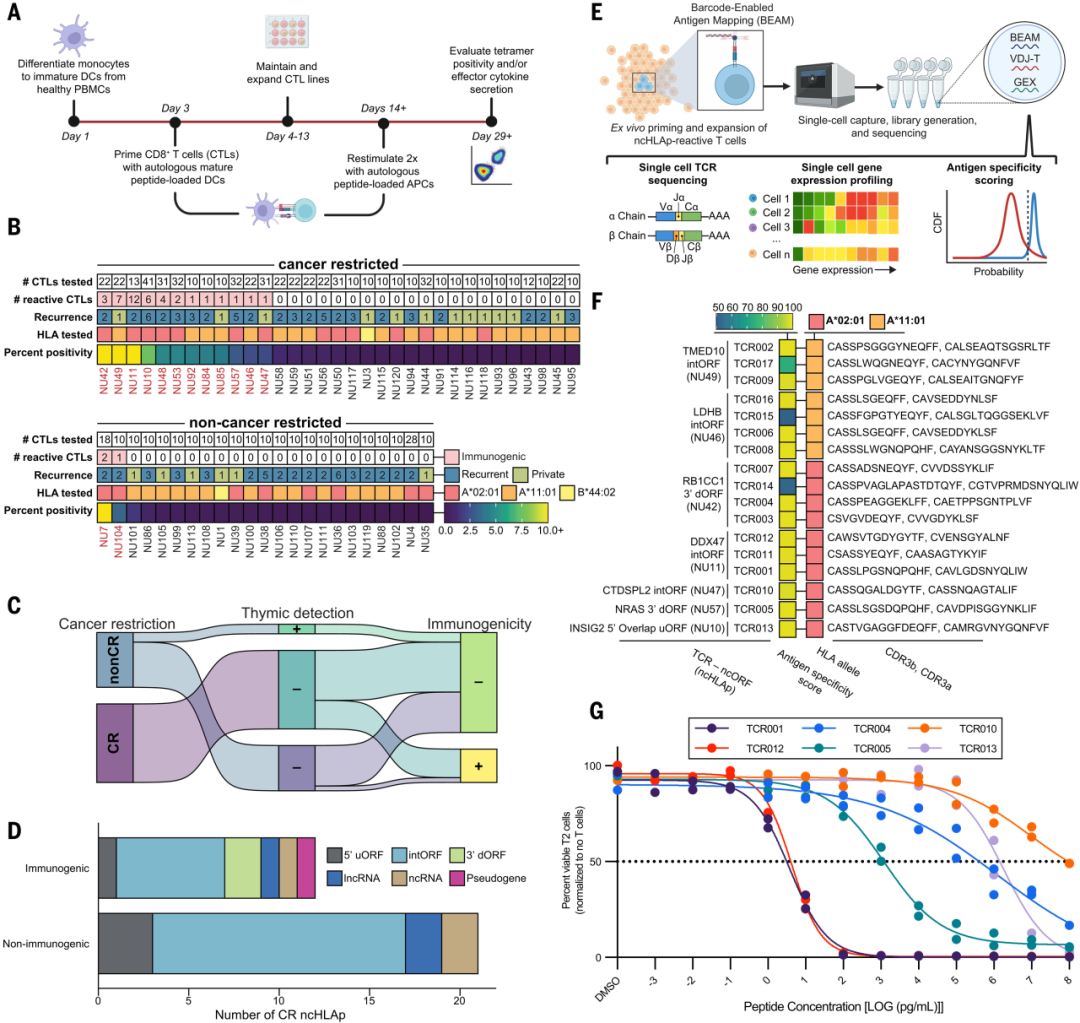
图:PDAC 特异性CR ncHLAp 表现出免疫原性潜力
04 ncHLAp特异性T细胞的肿瘤杀伤能力
研究团队将可特异性识别肿瘤限制性CR ncHLAp的T细胞受体(TCR)转导进敲除了内源性TCR的T细胞中,以验证其识别PDO中CR nUHLAp及发挥细胞毒性的能力。
实验结果显示,这些TCR-T细胞在体外和体内模型中都表现出了强大的抗肿瘤活性,能够特异性地识别并杀死表达内源性非典型抗原的胰腺癌类器官。特别是针对NU11肽的TCR001和TCR012,在体外实验中显示出极高的结合亲和力(EC 50分别为 3.7 和 4.3 pg/ml)。
皮下移植PDAC PDO至无胸腺小鼠体内,发现注射TCR 001-T可重定向T细胞,并显著延迟肿瘤进展(P < 0.001)。
该结果表明,靶向胰腺癌中的隐蔽抗原具有开发为疗法的价值。
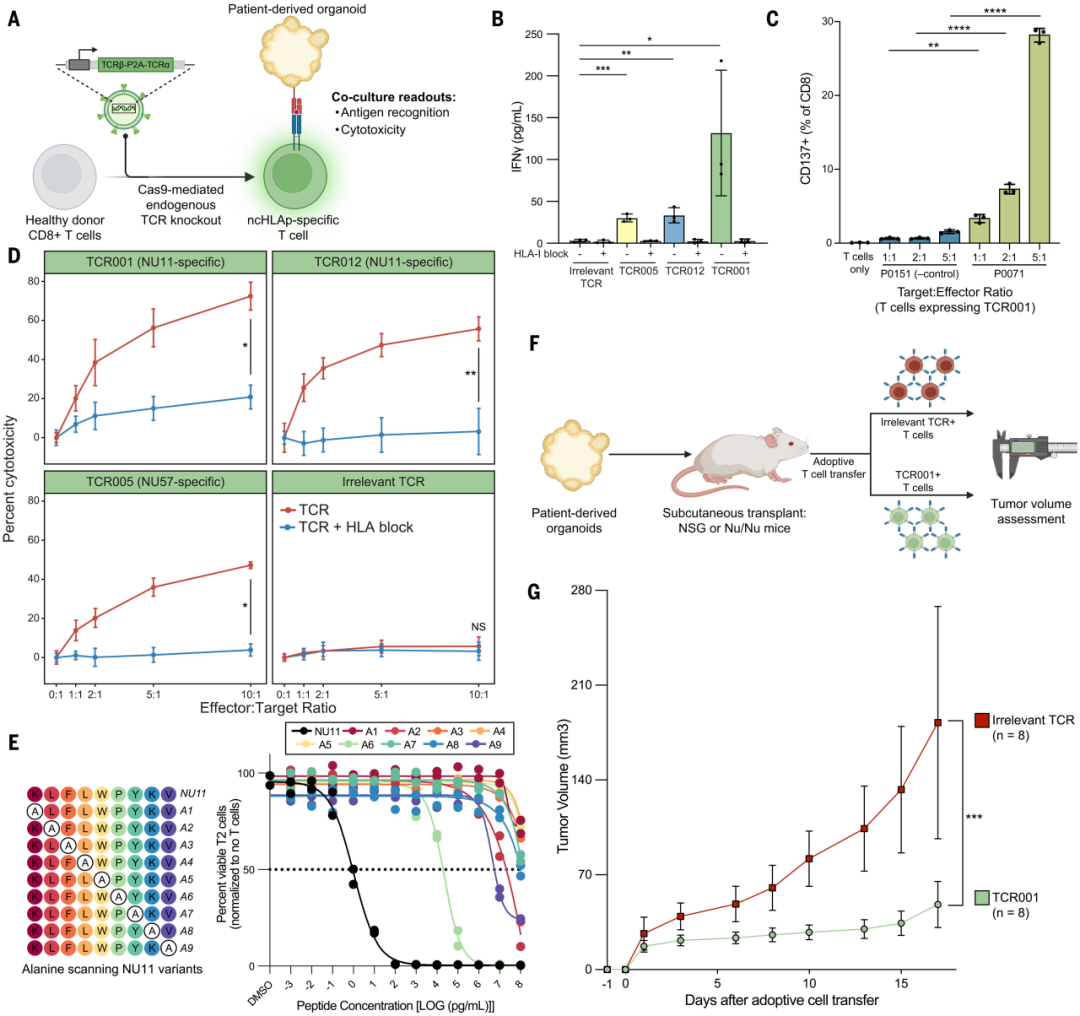
图:CR ncHLAp 特异性 T 细胞可以在体内和体外识别并杀死胰腺癌类器官
05 总结
本文使用患者来源的类器官,筛选从而填补了癌症抗原肽研究中,“非经典肽的肿瘤限制性”和“非经典肽的免疫原性”两大空白,发现胰腺癌中的异常翻译可产生能够被T细胞识别的隐蔽抗原,并鉴别了一组具有肿瘤限制性、免疫原性的隐蔽肽,其可直接靶向人胰腺肿瘤细胞,有望成为值得进一步研究的潜在治疗靶点。
近岸蛋白相关产品
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
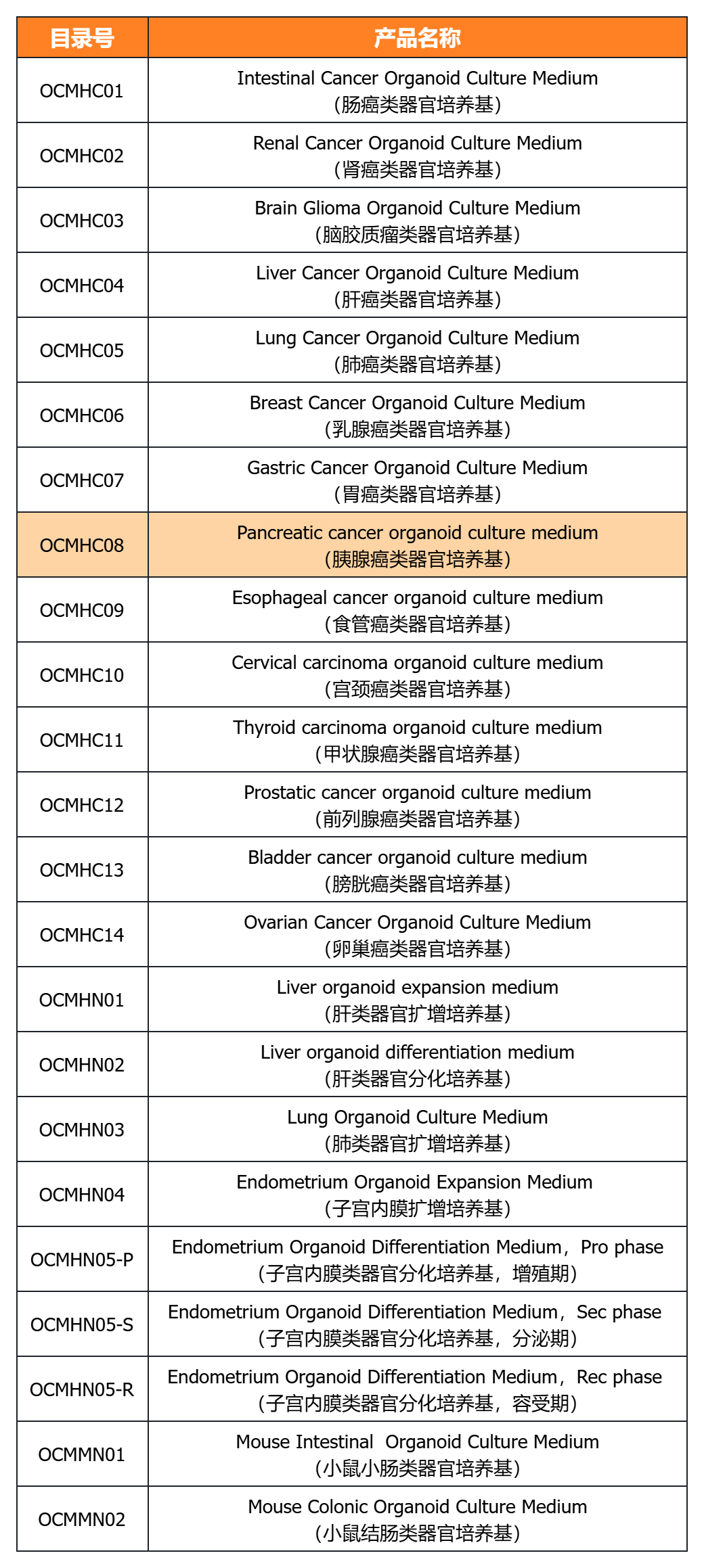
经类器官培养验证的完全培养基
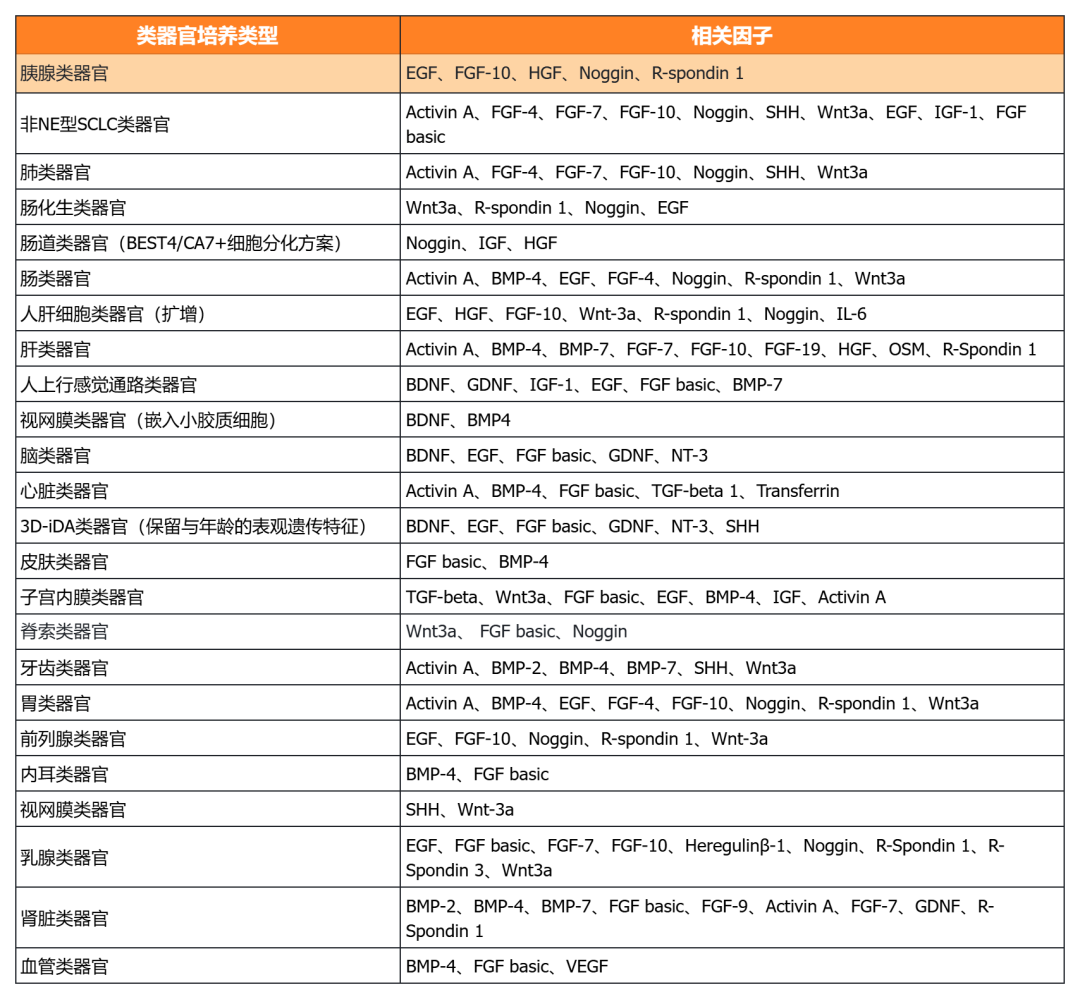
经类器官培养验证的细胞因子
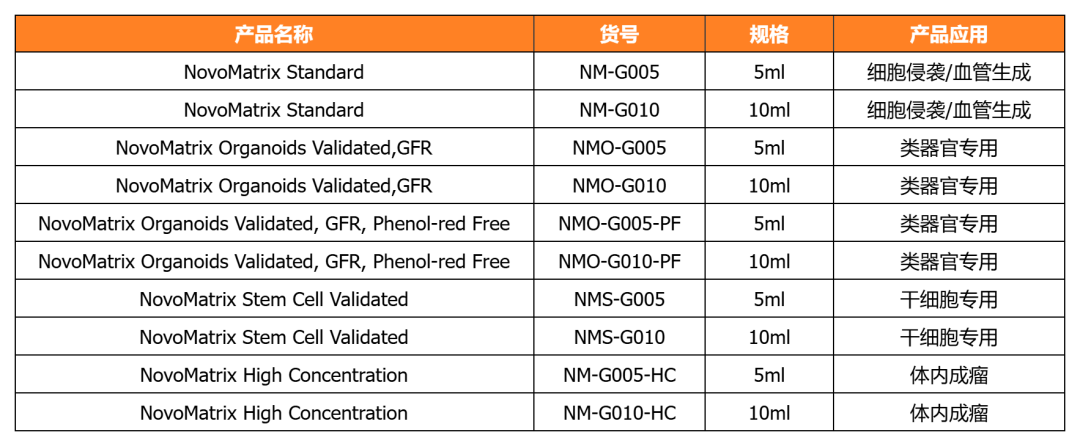
NovoMatrix 基质胶
参考资料
-
Ely, Zackery A et al. “Pancreatic cancer-restricted cryptic antigens are targets for T cell recognition.” Science (New York, N.Y.) vol. 388,6747 (2025): eadk3487. doi:10.1126/science.adk3487
